Vers la personnalisation du traitement des cancers
(Cet article est extrait de L'Édition n°17)
L’évolution du dépistage des cancers ainsi que les réponses thérapeutiques apportées suivent les progrès de la science. Avant que l’étude de la radioactivité ou les découvertes en pharmacologie donnent naissance aux radiothérapies et chimiothérapies, les premiers traitements chirurgicaux se limitaient aux cancers localisés et peu avancés. Aujourd’hui, les progrès de la génomique et de l’immunologie ouvrent la voie à l’adaptation du traitement aux spécificités de chaque patient.
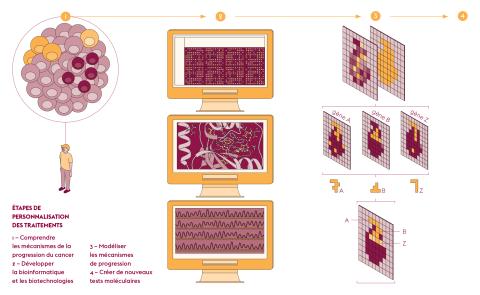
Chaque cancer est unique et les mécanismes génétiques propres à chaque patient en conditionnent l’apparition, l’évolution ainsi que leur réponse aux différents traitements. À partir de ce constat, le centre de recherche PRISM, labellisé Centre national de médecine de précision en oncologie, participe au développement de nouvelles pratiques et de traitements plus efficaces.
Modéliser le cancer
Fabrice André, responsable de l’unité Prédicteurs moléculaires et nouvelles cibles en oncologie (PMNCO – Univ. Paris-Saclay, Gustave Roussy, Inserm) et co-responsable de PRISM, résume son objectif : « Aujourd’hui, le séquençage de l’ensemble des gènes conduit à trouver des cibles thérapeutiques pour environ 20 % des cas de cancer. Nous voulons augmenter le nombre de patients bénéficiant du traitement le plus adapté, le plus tôt possible. » Pour étendre ces possibilités thérapeutiques au plus grand nombre, PRISM modélise chaque cancer, grâce à l’utilisation de l’intelligence artificielle qui structure et interprète les données issues d’essais cliniques de grande ampleur. Comme l’explique Fabrice André, « cette carte d’identité établit les mécanismes moléculaires et cellulaires spécifiques à chaque patient. Ces marqueurs pronostiquent le risque de récidive, prédisent l’efficacité des différents traitements ou la survenue d’effets indésirables ». Et si des résistances surviennent, ces informations aiguillent très rapidement vers d’autres traitements.
Au laboratoire PMNCO, l’équipe de Fabrice André a par ailleurs déjà identifié des marqueurs qui incluent par exemple une mutation dérégulant l’expression du gène TRIB3, ce qui induit une résistance à certains médicaments dans le cancer du sein. Ou le rôle du gène HLF, impliqué dans la réaction immunitaire, qui serait à l’origine de l’absence de protection immunitaire après une chimiothérapie.
Prédire l’efficacité des immunothérapies
L’immunothérapie fait partie des thérapies les plus susceptibles de bénéficier des apports de la médecine personnalisée. Plutôt que de viser directement les cellules cancéreuses, le traitement stimule la réponse antitumorale du système immunitaire. Les bénéfices sur le taux de survie sont déjà démontrés pour plus de vingt-cinq types de cancers différents. Les immunothérapies offrent par ailleurs des alternatives opportunes pour des cancers résistants à d’autres traitements, ainsi que pour des patients en situation de rechute.
Cette approche a toutefois des limites. Les immunothérapies sont bien mieux tolérées que les chimiothérapies, mais elles génèrent tout de même des effets secondaires, parfois sévères, de type auto-immun. De plus, certains patients tout d’abord réceptifs développent des résistances. Pourtant, comme l’explique Laurence Zitvogel, directrice de l’unité Immunologie des tumeurs et immunothérapie contre le cancer (ITIC – Univ. Paris-Saclay, Gustave Roussy, Inserm), « chez certains patients, on voit le cancer régresser, parfois disparaître complètement et de façon durable. Maintenant, l’objectif est d’augmenter le nombre de patients qui pourraient bénéficier de ces traitements. Il faut pour cela comprendre pourquoi cela ne fonctionne pas chez certains, et développer des associations qui potentialisent l’effet ».
Pour caractériser le profil immunologique de chaque tumeur, l’équipe du Pr Zitvogel utilise une approche « in sitro », combinaison d’« in situ » et d’« in vitro ». « In situ », puisque les tissus analysés proviennent de patients ayant déjà bénéficié d’une immunothérapie. « In vitro », car ces prélèvements reçoivent ensuite une stimulation par toute une variété d’immunomodulateurs. L’identification des molécules relarguées par les cellules tumorales livre alors de précieux renseignements sur les effets de différentes combinaisons d’immunothérapies, ainsi que les résistances éventuelles. Ces résultats constituent un premier pas vers l’élaboration de tests prédictifs de l’efficacité des différentes possibilités thérapeutiques.
Visualiser l’activité des gènes
Le développement du séquençage de l’ADN à haut débit a propulsé la biologie moléculaire dans le domaine des data sciences, accélérant son informatisation. La nécessité de mieux visualiser les informations issues de la lecture de l’expression des gènes a conduit à la création de MULTILAYER. Ce logiciel en libre accès est développé par Marco Mendoza-Parra, chercheur au laboratoire Génomique métabolique du Genoscope (Univ. Paris-Saclay, Univ. d’Évry, CNRS, CEA). « Notre outil permet de mieux exploiter les données de l’activité des gènes et leur localisation dans l’espace », explique-t-il. Ce type de lectures, connues sous le nom de « transcriptomique spatiale », est issu de la capture de l’ARN messager par un grand nombre de sondes à ADN, dont les positions sont répertoriées.
En confiant le traitement de ces informations à un système d’apprentissage automatique, le logiciel associe l’activité génique et l’information spatiale du tissu étudié. Les images produites sont constituées de « gexels », combinaison de gènes et pixels, d’une résolution de 100 micromètres, soit une dizaine de cellules. « Avec cette approche, l’information est perçue comme un continuum, ce qui est totalement nouveau, précise Marco Mendoza-Parra. Les gexels proches partagent des caractéristiques communes et dressent une cartographie fonctionnelle de l’expression des gènes. »
Cette technologie souffre pour le moment de coûts très élevés, liés au séquençage haut débit et à l’utilisation de sondes à ADN. Pour contourner cette limite et apporter plus de flexibilité, Marco Mendoza-Parra souhaite aller au-delà de l’analyse informatique, notamment par la production des puces à ADN nécessaires pour ces expériences. Ce nouveau type de visualisation aidera à décrypter la manière dont les gènes s’expriment au sein de la complexité tissulaire, et in fine la compréhension des mécanismes spécifiques de certaines pathologies.
Réduire les effets secondaires
La compréhension des mécanismes d’expression des gènes apporte aussi des informations utiles pour adapter les traitements anticancéreux à chaque patient. Lors d’une radiothérapie, les doses importantes de rayons X qui traversent les tissus pour atteindre les cellules tumorales provoquent parfois des réactions indésirables, généralement transitoires et de faible intensité. Mais 10 à 15 % de patients expérimentent des effets beaucoup plus sévères et durables. « Les tissus sains qui entourent la tumeur sont aussi irradiés : vaisseaux sanguins, tissus de soutien, organes situés à proximité, explique Michèle Martin, du Laboratoire de génomique et radiobiologie de la kératinopoïèse au sein de l’Institut de radiobiologie cellulaire et moléculaire (IRCM – Univ. Paris- Saclay, Inserm, CEA, Univ. de Paris). Ces complications regroupent des hypoplasies, une perte de substance pouvant conduire à la nécrose, ou à l’inverse des hyperplasies, lorsque les tissus réagissent en s’indurant jusqu’à la fibrose. »
Pour discerner ce qui distingue les patients radiosensibles des autres, la piste génétique a été privilégiée, mais sans aboutir jusqu’à présent à l’identification d’un gène précis. « Nous avons choisi une approche différente, car pour nous cette susceptibilité est multiparamétrique et concerne donc un ensemble de gènes, explique Michèle Martin. Nous nous sommes donc intéressés au transcriptome. » L’approche transcriptomique prend en compte l’ensemble des ARNs, qu’ils codent pour des protéines ou qu’ils jouent un rôle dans des mécanismes de régulation sans être traduits (ARN non codants).
Un des premiers résultats de cette analyse transcriptomique montre une altération du gène NFATC2, encore insoupçonnée. Impliqué dans l’apoptose et la multiplication cellulaire, NFATC2 subit chez les patients radiosensibles une répression de son expression, associée à un processus d’hyperméthylation, un mécanisme épigénétique courant. Pour Michèle Martin, « cette recherche en amont ambitionne de déboucher sur des tests cliniques de radiosensibilité, très attendus par les radiothérapeutes ». Le cancer est une maladie complexe, aux conséquences souvent lourdes, et le vaincre totalement semble pour l’instant hors de portée. Mais l’essor actuel de la médecine personnalisée révolutionne les options thérapeutiques, et augmente les chances de rémissions d’un nombre de patients chaque jour plus important.
Publications
- https://www.gustaveroussy.fr/fr/prism-ifi
- Agathe Dubuisson, et al. Immunodynamics of explanted human tumors for immuno-oncology. EMBO Molecular Medicine, 13, 2021.
- Julien Moehlin, et al. Inferring biologically relevant molecular tissue substructures by agglomerative clustering of digitized spatial transcriptomes with multilayer. Cell Systems, 12, 694-705, 2021.
- Joshua Dulong, et al. NFATC2 Modulates Radiation Sensitivity in Dermal Fibroblasts From Patients With Severe Side Effects of Radiotherapy. Frontiers in Oncology, 10, 2020
Son et lumière contre le cancer
Les méthodes de diagnostic et de traitement des cancers évoluent sans cesse vers des techniques moins invasives et générant moins d’effets secondaires. Aujourd’hui, la lumière polarisée sert à dépister certaines tumeurs. Bientôt, la simulation informatique étendra l’utilisation des ultrasons focalisés.
Plus la détection d’un cancer est précoce, plus la probabilité de le guérir augmente. C’est d’autant plus vrai pour les cancers de la peau, en particulier pour les mélanomes, dont les tumeurs métastasent rapidement. Mais la technique de détection actuelle, qui repose sur l’observation visuelle des tâches cutanées suspectes, présente une efficacité de 80 % : une tumeur sur cinq n’est ainsi pas repérée à temps. Élise Colin-Koeniguer, ingénieure de recherche à l’ONERA Palaiseau et co-fondatrice de la start-up ITAE Medical Research, développe un dispositif inédit de diagnostic précoce. « Le fonctionnement de l’appareil exploite le principe du speckle dynamique, utilisé depuis de nombreuses années pour observer la microvascularisation, explique Élise Colin-Koeniguer. Mais jusqu’à présent, cette technique n’était pas exploitée pour dépister les tumeurs, en raison de sa capacité insuffisante de pénétration sous la peau. » Le terme speckle fait référence aux tâches en mouvement que l’on perçoit en éclairant une surface avec un laser. Projetés sur la peau, certains photons sont réfléchis tandis que d’autres pénètrent plus profondément.
Voir les tumeurs sous la peau
« Grâce aux propriétés de polarisation de la lumière, nous neutralisons la réponse de surface pour accéder aux informations plus profondes », poursuit Élise Colin-Koeniguer. Ces informations concernent le déplacement du sang dans les capillaires qui irriguent les tissus.
Or le métabolisme hors-norme des cellules cancéreuses entraîne la création d’un réseau de vaisseaux sanguins pour les alimenter en nutriments et oxygène. « Avec nos collègues de l’Institut de pharmacologie et de biologie structurale (IPBS) à Toulouse, nous avons montré que notre appareil détecte cette microvascularisation dès le premier jour d’apparition d’une tumeur. Il n’existe pas à ma connaissance d’autres systèmes validés qui assurent une détection aussi précoce. » Plusieurs prototypes fonctionnels sont actuellement prêtés à des partenaires. « Six appareils circulent, et nous n’avons quasiment aucun retour de difficultés sur leur utilisation, précise Élise Colin Koeniguer. Les résultats sont en cours d’analyse, mais nous avons déjà prouvé la validité et la stabilité de la technique. »
La prochaine étape concerne la commercialisation du dispositif auprès des laboratoires hospitaliers. Le procédé suscite par ailleurs de l’intérêt au-delà de la cancérologie, avec des propositions de collaborations pour contrôler la vascularisation d’organes destinés à des greffes. À terme, la certification du produit par les autorités de santé débloquera le remboursement des actes associés, ce qui permettra à des dermatologues exerçant en cabinet d’accéder à cette technologie.
Des ultrasons qui guérissent
L’utilisation médicale des ultrasons débute dans les années 1970 par l’échographie, avant de trouver d’autres applications thérapeutiques comme la destruction de caillots sanguins ou de tumeurs. Aujourd’hui, la thérapie par ultrasons focalisés de haute intensité (HIFU) exploite les propriétés des ondes acoustiques concentrées par des « lentilles électroniques », comme une loupe fait converger les rayons lumineux. « Les contributions émises par les différents éléments de la sonde doivent arriver en même temps au point focal. L’énergie est alors concentrée dans une zone de la taille d’un grain de riz », explique Sylvain Chatillon, du Laboratoire d’intégration des systèmes et des technologies (LIST – Univ. Paris-Saclay, CEA). Les tissus ciblés absorbent l’énergie des ondes, provoquant leur échauffement thermique et la destruction des cellules.
L’innocuité des ultrasons de faible intensité confère à ces applications le statut de thérapies mini-invasives : les effets collatéraux sur les organes voisins et/ou sur les parties saines de l’organe traité sont très limités. Cette thérapie est particulièrement adaptée aux tumeurs faciles d’accès, situées dans des tissus mous au sein desquels les ultrasons se propagent bien. « C’est par exemple le cas du cancer prostate, précise Sylvain Chatillon. Mais si les ondes rencontrent des obstacles, comme des parois osseuses, elles circulent plus difficilement et leur focalisation devient plus complexe. »
Vers la simulation modulaire
Adapter le traitement HIFU à d’autres situations implique de modifier les protocoles et le matériel actuellement utilisé. Or, comme le remarque Sylvain Chatillon, « le développement de nouveaux protocoles de traitement demande des études très coûteuses en ressources et en temps avant leur validation par les autorités de santé ». Sur ce point, la simulation informatique offre une aide précieuse. La plateforme logicielle CIVA Healthcare du CEA List propose plusieurs modules de simulation, dont certains développés en partenariat avec l’Inserm. Ces modules optimisés et validés facilitent le calcul du champ acoustique transmis, celui de l’élévation locale de température et l’évaluation de la dose d’énergie thermique délivrée, afin d’estimer le contour de la lésion produite. L’approche concourt à prendre en compte, à des fins d’optimisation, d’analyse de sensibilité et de démonstration de performance, les nombreux paramètres impliqués dans un protocole de traitement.
Cette approche s’applique aussi à la personnalisation des thérapies. Comme le fait remarquer Sylvain Chatillon, « les variations des paramètres biologiques propres à chaque patient influencent l’efficacité du traitement. Notre modèle de substitution, construit par apprentissage à partir de bases de données de simulation, prend en compte ces spécificités pour fournir une simulation patient-dépendante en temps réel. À terme, cela déboucherait sur une personnalisation des protocoles afin d’optimiser les performances thérapeutiques ».
Ces innovations accroissent les possibilités de dépister et traiter le cancer. Elles ne remplaceront pas les techniques actuelles, mais viennent en complément pour offrir à chaque situation les solutions thérapeutiques les plus efficaces.
Publications
- https://www.itae.fr/fr/
- Sylvain Chatillon, et al. Applications of intensive HIFU simulation based on surrogate models using the CIVA HealthCare platform. Journal of Physics: Conference Series, 1761, 2020.