Radioactivité artificielle : il y a 90 ans, une découverte cruciale pour la médecine nucléaire
Cet article est issu de L'Édition n°27.
En 1935, Irène et Frédéric Joliot-Curie reçoivent le prix Nobel de chimie pour leur découverte de la radioactivité artificielle. En devenant les premiers à produire des éléments radioactifs, les deux scientifiques ouvrent la voie à de nombreuses applications, notamment dans le domaine de la médecine. Quatre-vingt-dix ans plus tard, des équipes de l’Université Paris-Saclay continuent d’enrichir cet héritage en développant de nouvelles molécules pour diagnostiquer ou traiter des maladies comme le cancer.
« Je n’ai pas l’ombre d’un souvenir de la découverte de la radioactivité artificielle », admet Hélène Langevin-Joliot, fille d’Irène et Frédéric Joliot-Curie. Mais « je me souviens de voir mes parents dans le bureau de ma mère et de les entendre dire : "On va avoir le Nobel !" ». C’était en novembre 1935. Un mois plus tard, le couple se rend en Suède pour recevoir le prix Nobel de chimie pour ses travaux sur la radioactivité artificielle. « C’était comme la dernière pièce d’un puzzle reconstitué au fil des années de recherches sur la radioactivité », raconte Hélène Langevin-Joliot. Un puzzle auquel ses grands-parents, Marie et Pierre Curie, ont déjà apporté des pièces cruciales, marquées de deux prix Nobel, en 1903 et 1911.
Suite à ces découvertes, les recherches sur la radioactivité vont bon train à cette époque mais pas sans difficultés. « Il faut comprendre qu’il y avait un blocage conceptuel par rapport à l’idée qu’une transmutation [la transformation d’un noyau atomique] pouvait produire non pas un atome stable mais un atome radioactif. C’était impensable », poursuit l’ancienne chercheuse en physique nucléaire, lors d’un événement organisé par le Laboratoire de physique des deux infinis - Irène Joliot- Curie (IJCLab - Univ. Paris-Saclay/CNRS/Univ. Paris-Cité) pour le 90e anniversaire de la découverte de la radioactivité artificielle.
C’est pourtant bien la prouesse que réalisent ses parents, Frédéric et Irène Joliot-Curie, en janvier 1934. À partir d’une feuille d’aluminium et d’une source de polonium, les deux scientifiques obtiennent du phosphore 30, alors nommé radiophosphore. Ceci devient le premier noyau radioactif artificiellement produit. « La radioactivité restait une propriété exclusivement attachée à une trentaine de corps présents dans la nature. La création artificielle de radioéléments ouvre un nouveau domaine à la science de la radioactivité », déclare Irène Joliot-Curie dans son discours, à la réception du prix Nobel.
Des isotopes en quête de stabilité
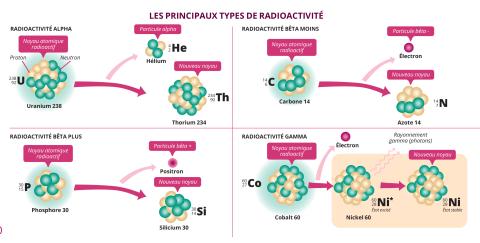
Pour comprendre l’importance de cette découverte, il faut plonger au cœur de la matière. Cette matière est composée d’atomes, eux-mêmes constitués de petites particules qui forment le noyau, les protons et les neutrons, et autour duquel gravitent des électrons. Un élément chimique est défini par son nombre de protons. Mais le nombre de neutrons associé varie d’un atome à l’autre. On parle d’isotopes pour désigner des atomes avec le même nombre de protons mais un nombre de neutrons différents. Le phosphore, caractérisé par ses 15 protons, possède ainsi plusieurs isotopes dont le phosphore 30 (30P) et le phosphore 31 (31P), qui renferment respectivement 15 et 16 neutrons.
En raison de cette différence de composition, tous les isotopes n’ont pas les mêmes propriétés. Certains sont dits stables : ils restent identiques à eux-mêmes extrêmement longtemps. D’autres sont instables : du fait de leur composition, ils ont un surplus d’énergie qu’ils vont évacuer en se désintégrant naturellement pour produire des éléments plus stables. C’est cela la radioactivité. Dans la nature, on observe quelques atomes radioactifs comme l’uranium 238 (238U). Mais l’immense majorité des atomes qui composent la matière ordinaire sont stables.
La durée de vie, également appelée période ou demi-vie, désigne la durée nécessaire pour que la moitié des noyaux d’un radioisotope se désintègre. Or, si l’238U affiche une période de 4,5 milliards d’années, elle est bien moindre pour la majorité des isotopes instables. Pour le 30P, elle ne dépasse pas les trois minutes. « Ces atomes ont une durée de vie très courte, c’est pour ça qu’on ne les observe pas dans la nature », explique Charles-Olivier Bacri, directeur de recherche au sein du pôle Physique et santé d’IJCLab. En montrant qu’il est possible de produire de tels isotopes, les Joliot-Curie ouvrent la porte vers des centaines d’atomes inconnus.
En fonction de leur composition, les isotopes radioactifs ne se désintègrent pas tous de la même façon pour gagner en stabilité. Ils émettent ainsi différents types de rayonnements, de nature différente : les rayonnements alpha (α), bêta (β) et gamma (γ). « Le rayonnement α est émis par les noyaux lourds qui possèdent beaucoup de protons et de neutrons. Il correspond à l’émission d’un noyau d’hélium composé de deux neutrons et deux protons », explique Charles-Olivier Bacri. C’est le cas notamment de l’uranium 238 (238U) qui se désintègre en thorium 234 (234Th). Le rayonnement β se produit au niveau des atomes possédant un déséquilibre entre le nombre de protons et celui de neutrons. « Quand le noyau a trop de neutrons, il se produit une transformation d’un neutron en proton. C’est ce qu’on appelle la radioactivité bêta moins (β-), qui s’accompagne de l’émission d’un électron (e-). » À l’inverse, quand l’excès concerne les protons, c’est un proton qui se transforme en neutron, avec émission d’un positron ou antiélectron (e+). C’est la radioactivité bêta plus (β+). La radioactivité α comme β implique une transformation du noyau de l’atome. Il existe cependant un autre type de rayonnement, le rayonnement γ, qui correspond à l’émission par le radioisotope de particules lumineuses ou photons. « Quasiment tous les noyaux radioactifs émettent aussi des rayons γ, qui permettent d’évacuer le surplus d’énergie qui leur reste », précise le physicien d’IJCLab.
De même qu’ils ne produisent pas les mêmes particules, ces trois rayonnements ont des propriétés et des intensités différentes. Les radiations α ont la particularité d’interagir intensément avec la matière et une simple feuille de papier ou l’épaisseur de la peau suffit à les arrêter. Moins ionisantes, les radiations β interagissent moins avec la matière mais sont plus rapides et plus pénétrantes. Une feuille d’aluminium ou une vitre est capable de les arrêter. Les rayons γ, quant à eux, sont les plus pénétrants. Une paroi épaisse de plomb ou de béton est nécessaire pour les bloquer.
Un tremplin vers la médecine nucléaire
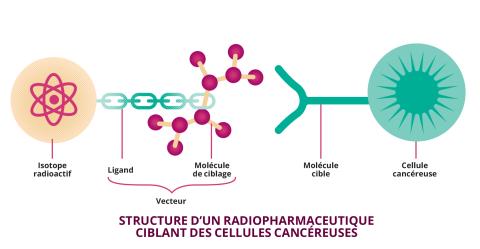
Quatre-vingt-dix ans après la découverte des Joliot-Curie, plus de 2 000 isotopes radioactifs ont été artificiellement créés. Et les applications de la radioactivité se sont démultipliées, en particulier dans le domaine de la médecine où une nouvelle spécialité a même vu le jour : la médecine nucléaire, qui consiste à utiliser des radioisotopes pour étudier le corps humain, diagnostiquer ou traiter des maladies comme les cancers. Pour y parvenir, les isotopes radioactifs ne sont pas utilisés seuls. Ils sont associés à des vecteurs – des molécules non-radioactives et généralement biologiques - pour constituer ce qu’on appelle des radiopharmaceutiques. « Ces molécules sont injectées dans le patient ou la patiente et sont distribuées, via la circulation sanguine, jusqu’à la zone cible à observer ou à traiter », explique Charles-Olivier Bacri. Chaque radiopharmaceutique est donc chargé d’une mission bien précise. « En imagerie médicale, l’objectif est d’arriver, grâce à la radioactivité, à détecter la zone cible sans déposer trop d’énergie dans le ou la patiente. En thérapie, c’est tout le contraire, l’objectif est de faire le plus de “dégâts” possibles à un endroit bien précis. » Chaque application ne fait donc pas appel aux mêmes radioisotopes, ni aux mêmes rayonnements.
En imagerie, les traceurs parmi les plus utilisés sont des émetteurs β+. Mais il existe différentes technologies. Les gamma-caméras, comme leur nom l’indique, observent le rayonnement γ, donc les photons émis par les radioisotopes, pour fournir une image de la zone ou de l’organe ciblé. La tomographie par émission de positons (TEP) repose, elle, sur la réaction entre le positron (e+) émis par le traceur et un électron de la matière environnante. Il en résulte l’émission de deux photons qui sont repérés par les détecteurs entourant le ou la patiente, ce qui permet de visualiser la zone cible de façon précise et de reconstruire son image en trois dimensions. Le fluor 18 (18F) est l’un des principaux marqueurs radioactifs utilisés pour l’imagerie. En cancérologie, il est par exemple utilisé sous forme de fluorodésoxyglucose (18F-FDG) pour cibler les cellules cancéreuses, qui sont très gourmandes en glucose, et observer les tumeurs. Mais les applications de ce radioisotope vont bien au-delà, comme le montrent les recherches menées au laboratoire d’Imagerie biomédicale multimodale Paris-Saclay (BioMaps - Univ. Paris-Saclay/CEA/CNRS/Inserm), hébergé par le Service hospitalier Frédéric Joliot (SHFJ) du CEA à Orsay.
À BioMaps, des radioisotopes produits sur place depuis cinquante ans
« Notre travail est de développer de nouveaux radiopharmaceutiques, principalement pour la TEP », indique Bertrand Kuhnast, directeur du SHFJ et directeur de recherche au sein de BioMaps. « Sur le 18F, nous faisons vraiment de la recherche translationnelle en collaboration avec d’autres spécialités. L’objectif est de s’interroger sur la façon d’incorporer ce fluor dans des molécules qui ont un intérêt en imagerie. Par exemple, un biologiste va nous dire qu’il est intéressé par telle protéine ou tel récepteur dans le cerveau. Nous cherchons alors comment imager cette cible avec un radiotraceur. »
Dans leurs recherches, les scientifiques de BioMaps disposent d’un remarquable atout : leur propre cyclotron, un accélérateur de particules qui produit des isotopes radioactifs en bombardant des éléments stables avec des protons. Pour le SHFJ, l’année 2025 ne marque d’ailleurs pas seulement les quatre-vingt-dix ans révolus de la découverte de la radioactivité artificielle mais aussi le 50e anniversaire de l’installation de son premier cyclotron arrivé en 1975. Si la machine a été démantelée depuis, deux autres cyclotrons l’ont remplacée au SHFJ, offrant la possibilité de produire sur place du 18F et du carbone 11 (11C), également utilisé en imagerie. Un avantage de taille au vu des périodes radioactives des isotopes, qui sont de moins de deux heures pour le premier et de vingt minutes pour le second.
Grâce à ces installations, l’équipe de BioMaps travaille au développement de radiopharmaceutiques expérimentaux, principalement dans les domaines de la neurologie et de l’oncologie. « L’année dernière, nous avons été sollicités pour produire un radiopharmaceutique pour un essai clinique de phase III, incluant une centaine de patientes et patients », relate Bertrand Kuhnast. Or, ce radiopharmaceutique, le [18F] LBT-999, n’est pas inconnu au sein de BioMaps puisqu’il est issu de travaux conjointement menés avec l’Université de Tours et la société Orphachem, et pour lequel un brevet de copropriété a été délivré en 2015.
Le [18F] LBT-999 est une molécule qui cible le transporteur de la dopamine et vise à détecter des pathologies comme la maladie de Parkinson, caractérisée par une dégénérescence des neurones producteurs de dopamine. Autre exemple de radiopharmaceutique codéveloppé au sein de BioMaps : le 18F-DPA-714, une molécule qui cible une protéine exprimée en trop grande quantité au sein de certaines cellules du cerveau en cas de neuroinflammation. « Ce radiopharmaceutique a été utilisé dans des essais cliniques sur des maladies neurodégénératives pour essayer de comprendre à quel moment intervient l’inflammation », précise Bertrand Kuhnast.
Si la neurologie et l’oncologie représentent les principaux domaines d’application des molécules mises au point par les équipes de BioMaps, ces dernières s’aventurent aussi sur d’autres thématiques. Une étude publiée en 2022 explique comment elles et ils ont réalisé le « radiomarquage » d’un médicament utilisé dans le traitement contre le VIH (virus d’immunodéficience humaine), le dolutégravir. « Lorsque les patientes et patients arrêtent la trithérapie, il y a systématiquement un rebond de la charge virale [la quantité de virus dans le sang]. Ceci pose un certain nombre de questions sur la pharmacocinétique du médicament », décrypte le directeur du SHFJ. Comment le dolutégravir interagit-il avec les réservoirs de virus et leur environnement dans l’organisme ? Pour le savoir, l’équipe de BioMaps remplace les atomes de fluor stables présents dans le médicament par son isotope radioactif. « Nous obtenons un radiotraceur qui a exactement la même structure que le médicament original, à la différence qu’il est possible de l’imager. » Ces travaux, toujours en cours, sont menés dans le cadre d’un projet de recherche européen, RHIViera, portant sur la rémission durable de l’infection par le VIH.
SIDONIE ou la question de la pureté des isotopes
Au sein de l’équipe Physique et santé d’IJCLab, les scientifiques travaillent aussi à développer de nouveaux radiopharmaceutiques. Depuis quelques années, Charles-Olivier Bacri et ses collègues s’intéressent toutefois à un critère particulier : la pureté des isotopes. « Pour fabriquer un radioisotope, on prend un élément stable et on le bombarde de particules pour obtenir l’atome instable correspondant », rappelle le physicien. Le problème est que les éléments stables utilisés sont rarement purs et se déclinent généralement en plusieurs isotopes. Après irradiation, ils ne produisent donc pas un radioisotope unique mais un cocktail de radioisotopes qu’il est très difficile de séparer. Or, « les radioisotopes supplémentaires sont potentiellement dangereux pour les patientes et les patients notamment parce qu’ils apportent une dose supplémentaire de radioactivité. Notre idée était de ne bombarder qu’un seul isotope stable, réduisant ainsi la diversité des radioisotopes produits. »
Grâce à son expérience de chercheur en physique fondamentale, Charles-Olivier Bacri ne cherche pas bien loin pour trouver le moyen en question. Il le trouve même juste à côté, dans l’ancien Centre de spectrométrie nucléaire et de spectrométrie de masse (CSNSM) où se trouve un séparateur d’isotopes aux performances exceptionnelles et uniques en Europe : SIDONIE. Mise en service en 1969 et toujours fonctionnelle, cette installation est capable d’aboutir à des taux de purification supérieurs à 99,9 %. Elle devient le point central du projet PRISM (Production d’isotopes et séparation pour le médical). Pour expérimenter le procédé, Charles-Olivier Bacri et son équipe jettent leur dévolu sur un radioisotope particulier : le terbium 155 (155Tb). « Le terbium est surnommé le couteau suisse parce qu’il a quatre radioisotopes d’intérêt potentiellement utiles pour le médical. Le 149Tb et le 161Tb présentent un intérêt pour la radiothérapie tandis que le 152Tb et le 155Tb peuvent être utilisés en imagerie. » Or, le 155Tb est principalement fabriqué à partir de gadolinium 155 (155Gd), disponible commercialement mais avec une pureté d’environ 92 %, démontrée comme insuffisante pour la production de terbium à usage médical.
Grâce à SIDONIE et son pouvoir de séparation, l’équipe d’IJCLab, associée aux ingénieurs responsables de la machine, aboutit à une purification des atomes de 155Gd de 99,98 %, et ainsi à la production de 155Tb d’une pureté a priori amplement suffisante. « L’idée était d’obtenir une preuve de concept. Le problème est qu’il s’agit d’un processus qui coûte cher et fournit de petites quantités des atomes d’intérêt. » Les scientifiques décident alors d’aller plus loin. Quel est le niveau de pureté optimal du gadolinium nécessaire pour une utilisation médicale du 155Tb ? « On sait que 92 % est une pureté insuffisante mais 99,98 % est peut-être beaucoup trop », détaille Charles-Olivier Bacri. À travers une étude encore en cours, son équipe tâche d’analyser ce qu’il se passe lorsque la pureté du 155Gd (et donc celle du 155Tb) se dégrade, en y ajoutant du 156Gd. « Si le niveau optimal est 94 %, cela devrait pouvoir être reproduit. Si c’est 98 %, ce sera plus compliqué. Cela veut dire qu’il faudra investir davantage pour avoir un séparateur presque aussi efficace que SIDONIE. »
La question de la pureté du radioisotope ne concerne pas seulement la santé des patients. Le 156Tb a le défaut d’émettre un rayonnement γ d’énergie proche de 2 millions d’électronvolts (MeV), contre environ 0,17 MeV pour le 155Tb. En plus de l’apport d’une dose potentiellement nocive au patient ou à la patiente, ceci est susceptible de polluer les observations réalisées à l’imagerie. Jusqu’où est-il possible d’aller sans que l’image ne soit polluée ? C’est ce que les scientifiques décident de voir à travers une autre étude. En mélangeant du 155Tb et du 156Tb et en utilisant une boîte en plastique simulant une souris, elles et ils observent comment le radioisotope 156 pollue l’image. « Au bout d’un moment, si l’image est trop polluée, ça ne sert plus à rien de la faire, même si le patient ou la patiente supporte très bien la dose. » À partir de ces deux critères, la dosimétrie et la pollution de l’image, l’équipe espère déterminer la pureté optimale pour utiliser le 155Tb dans les meilleures conditions.
Coupler diagnostic et traitement avec les radioisotopes
Avec un tel couteau suisse en poche, les recherches de Charles-Olivier Bacriet ses collègues ne peuvent en rester là. À partir des radioisotopes du terbium, elles et ils tentent de développer des radiopharmaceutiques susceptibles de servir à l’imagerie, à la radiothérapie voire les deux. C’est ce qu’on appelle la théranostique, qui consiste à coupler diagnostic et traitement. L’iode 131 (131I), utilisé contre les cancers de la thyroïde, en livre un exemple précurseur. Ce radioisotope a l’avantage d’émettre des rayonnements β- et γ qui sont utiles à la fois pour observer et traiter les tumeurs thyroïdiennes. Avec le terbium, « nous avons quatre radioisotopes qui peuvent être couplés deux par deux, un pour l’imagerie, l’autre pour la thérapie. Étant donné qu’ils ont tous la même chimie et des masses très proches, ils vont avoir la même dynamique. On pense que ce serait de très bons éléments théranostiques. »
Car à IJCLab comme à BioMaps, le développement des radiopharmaceutiques est une gymnastique complexe qui ne se résume pas à identifier des isotopes d’intérêt. Il faut aussi trouver un moyen de les associer et de les adresser au bon endroit dans l’organisme. C’est le rôle des vecteurs intégrés dans les radiopharmaceutiques. Il peut s’agir d’un simple peptide ciblant un récepteur présent au niveau des cellules malades ou alors d’un vecteur plus complexe, comme un anticorps. « Les anticorps se fixent sur des antigènes spécifiques. En les utilisant, il est possible de cibler plus spécifiquement une tumeur », décrypte le physicien. Développer de tels radiopharmaceutiques est néanmoins difficile. Les anticorps ont un temps de distribution dans l’organisme de plusieurs jours, voire semaines. Il est donc nécessaire d’utiliser des radioisotopes dont la demi-vie est suffisante et compatible pour persister durant l’intégralité des étapes, sans apporter toutefois une dose de rayonnements inutiles à l’organisme. À cela, s’ajoute notamment le défi chimique de lier le radioisotope à l’anticorps.
Si les recherches sont encore en cours dans le domaine, elles ouvrent des perspectives importantes. Celles d’observer de nouvelles choses et de développer de nouveaux traitements grâce aux radioisotopes. Mais aussi d’aboutir à une médecine nucléaire de plus en plus personnalisée. Il s’avèrerait alors possible d’adapter la dose délivrée aux spécificités de chaque patient ou patiente afin de les traiter le plus efficacement possible, tout en limitant les effets secondaires liés à la radioactivité.
Références :
- Association Curie et Joliot-Curie :
https://curie-joliotcurie.fr/ - Lavisse et al., Increased microglial activation in patients with Parkinson disease using [18F]-DPA714 TSPO PET imaging, Parkinsonism and Related Disorders 2021.
- Huvelle et al., Improved automated radiosynthesis of [18F]Dolutegravir: Toward clinical applications, ACS Omega 2024.
- Köster et al., Electromagnetic isotope separation of gadolinium isotopes for the production of 152,155Tb for radiopharmaceutical applications, Nuclear Instruments and Methods in Physics Research Section B 2020.
- Bouteculet et al., First production of pure 155Gd targets and 155Gd(p,x)155Tb, 156Tb cross-section measurements, Applied Radiation and Isotopes 2024.

Cet article est issu de L'Édition n°27.
L'intégralité du journal est à découvrir ici en version numérique et sur Calaméo.
Pour découvrir d'autres articles et sujets, abonnez-vous au journal L'Édition et recevez les prochains numéros :