L’origine génétique d’une forme rare du syndrome de Cushing enfin identifiée
L’hyperplasie macronodulaire des surrénales avec syndrome de Cushing est une maladie rare, dont une forme plus singulière encore est dépendante de l’alimentation. Sous la supervision de Peter Kamenický, professeur en endocrinologue au CHU de Bicêtre et directeur du laboratoire Physiologie et physiopathologie endocriniennes (PHYSENDO – Univ. Paris-Saclay, Inserm), une équipe de chercheurs et de chercheuses impliquant pas moins de six pays en a élucidé la cause génétique. Trente ans après la première description de la pathologie, cette découverte ouvre la voie vers un diagnostic plus précoce et une meilleure prise en charge des patients.
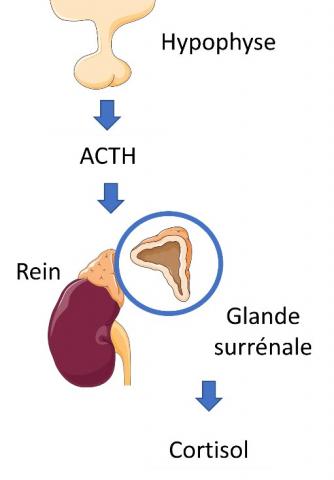
Le plus souvent, le syndrome de Cushing résulte d'un traitement par glucocorticoïdes exogènes de maladies auto-immunes ou inflammatoires, comme la polyarthrite rhumatoïde. En revanche, le syndrome de Cushing endogène est dû à l’hypercortisolisme, c’est-à-dire une production excessive du cortisol dans l’organisme. Cette hormone est sécrétée par les surrénales, des glandes situées au-dessus des reins, sous la stimulation d’une autre hormone, l’adrénocorticotropine, elle-même produite par l’hypophyse.
Le cortisol joue un rôle essentiel sur la glycémie ou encore le métabolisme des lipides, protéines et glucides. Les symptômes associés à l’hypercortisolisme sont multiples, les plus communs étant une redistribution de la graisse vers l’abdomen combinée à une atrophie musculaire. De façon plus aléatoire, elle s’adjoint d’obésité, d’ostéoporose, de diabète sucré, d’hypertension artérielle ou encore d’une tendance à la dépression ; les risques cardio-vasculaires sont alors clairement plus élevés.
Des formes rares, dont une liée à l’alimentation
Au sein du laboratoire, l’équipe de Peter Kamenický mène des travaux de recherche sur la tumorigenèse endocrinienne, c'est-à-dire le mécanisme de développement des tumeurs endocrines, notamment d’origine hypophysaire et surrénalienne. Le chercheur décrit les principales causes endogènes du syndrome de Cushing : « Généralement, des tumeurs au niveau de l’hypophyse sécrètent en excès l’adrénocorticotropine, qui sur-stimule les surrénales et aboutit à l’hypercortisolisme. Mais il y a aussi des formes plus rares du syndrome, d'origine surrénaliennes, où les surrénales elles-mêmes produisent trop de cortisol. »
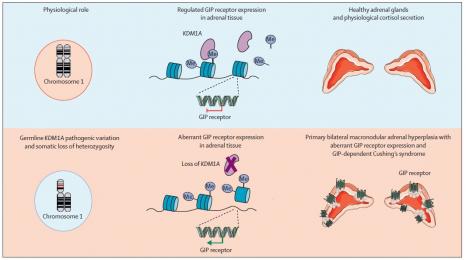
Dans ce cas, l’hypercortisolisme peut être lié à une hyperplasie macronodulaire des surrénales, une affection caractérisée par des glandes surrénales imposantes et couvertes de macronodules bilatéraux. « Or, dans cette forme, il y a un sous-groupe encore plus rare, dans lequel la production d'excès de cortisol, et probablement aussi l'augmentation du volume des surrénales, est déterminée par la présence d'un récepteur qui n'a rien faire dans les surrénales, rajoute le chercheur. On parle d'expression illégitime ou aberrante du récepteur du GIP. »
Le GIP (Glucose-dependent insulinotropic polypeptide), ou peptide insulinotrope dépendant du glucose, est un peptide gastrointestinal produit par les cellules de l'intestin grêle en réponse à la prise alimentaire. Les patients atteints de cette forme très rare du syndrome de Cushing GIP-dépendant (ou dépendant de l'alimentation) ont un faible niveau de cortisol à jeun, qui augmente après une prise alimentaire en lien avec l’expression aberrante des récepteurs du GIP dans leurs surrénales.
Une origine génétique différente selon les formes de la maladie
Jusqu'à 2013, l’origine génétique de l'hyperplasie macronodulaire bilatérale des surrénales est totalement inconnue. Une équipe française décrit qu'environ 25 % de tous les patients présentent une mutation sur le gène ARMC5, mais ces mutations ne sont jamais retrouvées chez les patients avec l'hyperplasie macronodulaire bilatérale avec l’expression du récepteur du GIP.
Avec son équipe, le chercheur s’empare du sujet et publie une première observation en 2017. Mais c’est seulement l’étude d’un cas de présentation familiale (la maladie se présente chez plusieurs membres d'une même famille) qui permet une avancé essentielle dans la compréhension de la pathogénie de cette maladie énigmatique.
« Tout est parti de l'observation commune d'une délétion du bras court du chromosome 1, relate Fanny Chasseloup, endocrinologue et doctorante sous la direction de Peter Kamenický. On a regardé s'il n'y avait pas d’évènements génétiques intéressants à ce niveau-là et en croisant les données du séquençage, on a identifié une mutation sur le gène KDM1A codant pour une lysine déméthylase. Il a donc fallu vérifier quelle était l'implication de cet évènement dans l'hyperplasie macronodulaire des surrénales. »
Une collaboration internationale pour constituer une cohorte de patients
S'agissant d'une maladie très rare, le laboratoire collabore étroitement avec le Canada, mais également avec la Belgique, l'Italie, la Grèce et la Hollande pour récupérer des cas d'hyperplasie macronodulaire des surrénales, dont des cas contrôles sans expression du récepteur du GIP.
« C’est ainsi que nous avons constitué une collection de tissus de patients, reprend Fanny Chasseloup, dans laquelle nous avons retrouvé exactement le même évènement génétique, c'est-à-dire des mutations germinales et une perte du bras court du chromosome 1. »
Le rôle important joué par la population contrôle de l’étude est à souligner car les équipes constatent que cet évènement génétique n'est pas présent chez tous les patients atteints d’hyperplasie macronodulaire des surrénales mais uniquement chez ceux dont le syndrome de Cushing dépend de l'alimentation. « Ce résultat nous a conforté dans l'implication de cet évènement génétique dans la survenue de la maladie », convient la jeune chercheuse.
Une découverte génétique qui ouvre la voie vers un meilleur diagnostic
En effet, la combinaison de la mutation germinale héréditaire de KDM1A et de la perte du bras court du chromosome 1 dans le tissu surrénalien conduit à la perte de fonction du gène. « L'absence d'expression de la protéine codée par ce gène suppresseur de tumeur aboutit au développement des lésions surrénaliennes », conclut Peter Kamenický.
KDM1A est également un répresseur transcriptionnel, c’est-à-dire qu’il a pour fonction d’empêcher l’expression de certains gènes. La perte de fonction de KDM1A dans le tissu surrénalien aboutit à l’expression aberrante de récepteurs couplés aux protéines G, parmi lesquels le récepteur du GIP.
GIP-dépendante avec syndrome de Cushing (Source : Chasseloup et al.
https://doi.org/10.1016/S2213-8587(21)00236-9)
Ces découvertes constituent une percée significative vers l’identification précoce de la maladie dans les familles à risque et une meilleure prise en charge, et font d’ailleurs l’objet d’une valorisation sous la forme d’un dépôt de brevet. Elles sont d’autant plus importantes que les mutations de KDM1A prédisposent aussi au myélome multiple et probablement à d’autres types de cancers. Elles n’en apportent pas moins de nouvelles interrogations, notamment sur l’expression aberrante des autres récepteurs que celui du GIP et leur rôle dans le développement des lésions surrénales, ou encore sur le rôle de la mutation de KDM1A dans la formation de myélomes.
Références :
- Chasseloup F, Bourdeau I, Tabarin A, et al. Loss of KDM1A in GIP-dependent primary bilateral macronodular adrenal hyperplasia with Cushing’s syndrome: a multicentre, retrospective, cohort study. Lancet Diabetes Endocrinol 2021; published online Oct 13.
- Lecoq A., Stratakis C., Viengchareun S., Chaligné R., Tosca A. et al. Adrenal GIPR expression and chromosome 19q13 microduplications in GIP-dependent Cushing’s syndrome. JCI Insight, American Society for Clinical Investigation, 2017, 2 (18).