
Les virus : de potentiels vecteurs génétiques pour le transfert entre espèces
« Jumping genes » ou encore « gènes sauteurs », ces éléments du génome seraient capables de se transmettre d’une espèce à une autre. Pour identifier leur mode d’action, des chercheurs du laboratoire Évolution, génomes, comportement et écologie (EGCE - Université Paris-Saclay, CNRS, IRD) étudient les virus et les envisagent comme de potentiels vecteurs génétiques.
Les éléments transposables, aussi appelés gènes sauteurs, sont des séquences d’ADN capables de se déplacer d’un chromosome à un autre. Présents dans tous les organismes, ils représentent environ 50 % du génome humain. Néanmoins, ils sont considérés comme des parasites génomiques : une fois installés au sein de l’ADN, impossible de les en déloger. Facteur aggravant : leur présence est néfaste pour l’hôte puisqu’ils sont source de maladies génétiques. L’organisme ne peut les éliminer. Seules des mutations génétiques combinées à la sélection naturelle parviennent à les inactiver et à les dégrader.
Intégrés à l’ADN de l’hôte, les éléments transposables se transmettent naturellement de génération en génération, par la reproduction. On parle alors de transfert vertical. Mais ils peuvent également se transmettre entre espèces différentes. C’est ainsi que des séquences d’ADN identiques se retrouvent chez la punaise hématophage Rhodnius et le Singe-Écureuil. Ce phénomène encore inexpliqué porte le nom de transfert horizontal. Clément Gilbert, chercheur au laboratoire Évolution, génomes, comportement et écologie (EGCE - Université Paris-Saclay, CNRS, IRD) mène plusieurs études pour élucider son mécanisme.
Inégalité de fréquence de transferts entre éléments transposables
Généralement, les éléments transposables sont classés en deux groupes, selon leur mode de transfert horizontal : le groupe 1 réunit ceux qui appliquent le « copier-coller », et le groupe 2 le « couper-coller ». Dans le cas du premier groupe, une enzyme transcrit l’élément transposable en ARN (copier) puis le rétrotranscrit en ADN (coller). Dans le second groupe, une enzyme coupe le brin d’ADN (couper), en extrait l’élément transposable et le réintègre ailleurs dans le génome (coller).
Curieusement, ces deux modes de transfert ne s’observent pas à la même fréquence dans les organismes : le mode employé par le groupe 1 est plus largement utilisé que celui du groupe 2. Pour éclaircir le sujet, Clément Gilbert et son équipe ont mesuré les contraintes agissant sur les éléments transposables lors des différents types de transferts, chez près de 307 espèces de Vertébrés.
Les éléments transposables sont globalement tous soumis à la sélection naturelle et subissent des mutations qui les inactivent. Pour ceux du groupe 2, leur déplacement au sein du génome de l’hôte s’effectue indépendamment de leur activité, puisque l’enzyme qui se charge de les transporter ne reconnaît pas cet état. Les mutations se succèdent alors dans le temps et le taux de copies inactives de l’élément augmente au sein du génome. À l’inverse, la reconnaissance des éléments du groupe 1 par l’enzyme est nécessaire pour que celle-ci effectue le « copier-coller ». Ils ne sont transcrits que s’ils sont actifs. Au fil du temps, on observe spécifiquement une accumulation d’éléments fonctionnels, ce qui induit alors une plus large transposition des éléments du groupe 1. C’est ce qu’on appelle la sélection purifiante.
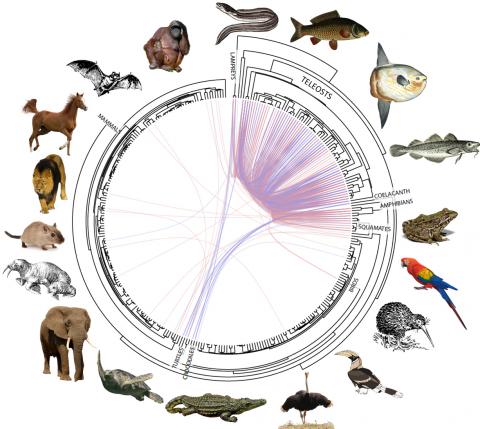
Inégalité de fréquence de transferts horizontaux entre espèces
Plus étonnant encore, les transferts horizontaux ne se produisent pas à la même fréquence chez toutes les espèces. Pour identifier l’origine de ce phénomène, l’équipe de Clément Gilbert a quantifié le nombre de transferts horizontaux chez les 307 espèces de vertébrés. Les chercheurs ont analysé le génome de chaque espèce, pour identifier les éléments transposables, puis ont sélectionné uniquement leurs transferts horizontaux.
Ils ont décompté pas moins de 975 évènements de transferts horizontaux, dont la grande majorité chez les poissons téléostéens. Ce résultat surprenant amène à s’interroger sur la raison qui fait que les poissons soient autant ciblés. « On peut énoncer plusieurs hypothèses, mais nous n’avons pas de réponse établie à l’heure actuelle. Il peut s’agir d’un excès de transfert chez les poissons téléostéens ou d’un manque de transfert chez les autres espèces de Vertébrés. On peut également penser que la fécondation externe des poissons augmente les chances d’intégration d’ADN étranger », avance Clément Gilbert.
Les virus, une source de transfert génétique entre espèces
Mais alors, comment un gène étranger s’intègre-t-il au sein d’un organisme ? À ce jour, le mécanisme des transferts horizontaux reste inexpliqué. Cependant, Clément Gilbert tend à penser que les parasites et virus y jouent un rôle prépondérant. « Les virus se répliquent au sein des cellules de leur hôte. Leur matériel génétique est donc très proche de celui de l’hôte. Il pourrait y avoir des échanges d’ADN entre les deux », explique le chercheur.
Certains virus peuvent être des vecteurs génétiques entre deux espèces d’hôtes. Mais plusieurs conditions doivent être remplies : il faut que le virus soit transmissible entre ces deux espèces, qu’il ne les tue pas et qu’il y ait ensuite un transfert vertical pour que l’élément transposable perdure au sein de la deuxième espèce. « Après avoir intégré l’élément transposable du premier hôte, et s’il ne tue pas son hôte et n’est pas rejeté dans l’environnement, le virus sera transmis à un second hôte. S’il atteint les cellules germinales, il sera capable d’y pénétrer, de se répliquer et de transposer l’élément du premier hôte », détaille Clément Gilbert.
Pour étayer cette hypothèse, le chercheur a monté le projet TransVir, dans le but d’étudier le potentiel qu’ont certains virus à être des vecteurs de transferts horizontaux. Développé notamment en collaboration avec le laboratoire Écologie et biologie des interactions (EBI - Université de Poitiers, CNRS) et l’Institut de recherche sur la biologie de l’insecte (IRBI – Université de Tours, CNRS), le projet a bénéficié d’un financement de l’Agence nationale de recherche (ANR) d’un montant de 240 000 € pour une durée d’environ cinq ans (décembre 2015 – mars 2021).
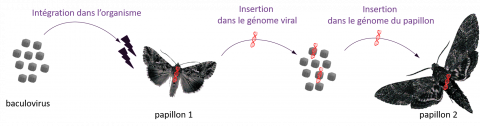
Ensemble, les chercheurs se sont intéressés aux transferts horizontaux existant chez les insectes et mettant en jeu des baculovirus. Les résultats obtenus ont rapidement montré qu’en moyenne 5 % des génomes de baculovirus portent un élément transposable provenant de chenilles de papillons. Cela vient confirmer la première étape du mécanisme de transfert depuis un hôte vers un virus.
Dans les prochaines années, Clément Gilbert souhaiterait renouveler cette collaboration autour d’un nouveau projet ANR afin d’étudier la seconde étape du mécanisme : le transfert depuis le virus vers un second hôte. Il envisage également d’étudier le potentiel des vésicules extracellulaires comme vecteurs de transferts horizontaux. Ces organites, qui assurent la communication entre les cellules, pourraient également être une source de transfert génétique entre espèces.
*Les baculovirus infectent un papillon 1. Lors de la réplication du virus, les éléments transposables du papillon 1 sont insérés dans le génome viral. Celui-ci les transporte vers le papillon 2. Lors de l’infection du papillon 2, les éléments transposables du papillon 1 portés par le virus transposent dans le génome du papillon 2 entraînant un transfert horizontal.
- Gilbert, C., Peccoud, J., & Cordaux, R. Transposable Elements and the Evolution of Insects. Annual Review of Entomology, 66 (2020).
- Zhang, H. H., Peccoud, J., Zhang, X. G., & Gilbert, C. Horizontal transfer and evolution of transposable elements in vertebrates. Nature communications, 11(1), 1-10 (2020).
