Ménopause : un tabou à démystifier pour la santé des femmes
Cet article est issu de L'Édition n°26.
La ménopause est une étape naturelle de la vie des femmes et dont les effets se font à la fois ressentir sur la santé et la qualité de vie. Pourtant, elle demeure un sujet tabou. À l’Université Paris-Saclay, des chercheurs et chercheuses tentent de mieux comprendre cette étape physiologique importante et ses manifestations, afin d’en améliorer la prise en charge et de lever le tabou qui l’entoure.
En 2030, quelque 1,2 milliard de femmes seront âgées de 50 ans et plus, selon l’Organisation mondiale de la santé (OMS). C’est autant de femmes qui seront concernées par la ménopause, autrement dit l’arrêt de leur fonction reproductive. Avec une espérance de vie moyenne de 85 ans pour les femmes, cela signifie que bon nombre d’entre elles vivront plus d’un tiers de leur vie ménopausées. Malgré tout, ce processus physiologique demeure un sujet largement tabou. « Les femmes sont très peu informées sur la ménopause alors qu’elle fait partie des étapes qui composent le continuum de leur vie », confirme Micheline Misrahi-Abadou, professeure de biochimie et biologie moléculaire à la Faculté de médecine Paris-Saclay.
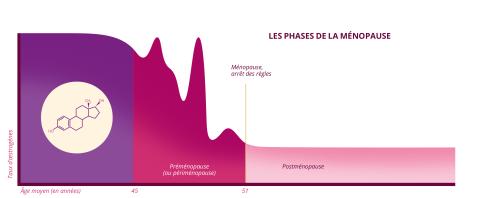
La ménopause est marquée par l’arrêt du fonctionnement des ovaires et se manifeste par l’arrêt des règles pendant une période consécutive d’au moins un an. Le phénomène montre toutefois une très grande variabilité : il peut intervenir dès 45 ans et jusqu’à 55 ans voire au-delà, l’âge moyen étant de 51 ans en France. « Avant 45 ans, on parle de ménopause précoce, et avant 40 ans, d’insuffisance ovarienne prématurée qui correspond à une infertilité pathologique », précise la chercheuse qui dirige l’unité de génétique moléculaire des maladies métaboliques et de la reproduction (UGM3R - Univ. Paris-Saclay/AP-HP) à l’hôpital Bicêtre. Mais cet arrêt de la fonction ovarienne ne survient pas brusquement. Il s’agit au contraire d’un processus long qui s’étale sur plusieurs années. On parle ainsi de préménopause (appelé périménopause dans le système anglo-saxon) pour désigner la période de transition menant à la ménopause.
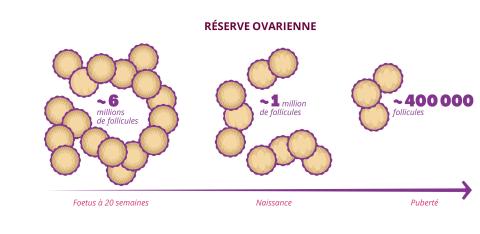
Chez la femme (et toute personne dotée d'un utérus et d'ovaires), la durée de la vie reproductive dépend de la réserve ovarienne, le stock de follicules contenus dans les ovaires. « Ces follicules sont de petites sphères qui contiennent l’ovule ainsi que des cellules protectrices et nutritives », explique Micheline Misrahi-Abadou. Or, ce stock de follicules ne se forme qu’une seule fois dans la vie d’une femme, lors du développement prénatal. Au septième mois de grossesse, on estime que le fœtus féminin possède environ sept millions de follicules. À la naissance, il n’en reste plus qu’un million, puis 400 000 à la puberté. Et ce stock ne cesse de diminuer au fil de la vie reproductive. « Une femme ne va ovuler qu’environ 500 fois durant sa vie reproductive. La principale cause de diminution de la réserve ovarienne n’est donc pas l’ovulation mais un mécanisme d’atrésie folliculaire, c’est-à-dire une destruction spontanée des follicules. »
Prédire la ménopause grâce à la génétique ?
Bien que cette atrésie soit identifiée, ses mécanismes sont mal compris. Ce qui rend la ménopause impossible à prévoir. « Il n’y a actuellement aucun dosage, ni biomarqueur pour prédire quand la réserve ovarienne va disparaître », confirme Micheline Misrahi-Abadou. Récemment, une voie s’est pourtant ouverte grâce à la génétique. « On connaît très mal les gènes qui contrôlent la fertilité humaine. On sait en revanche que l’âge de la ménopause est très contrôlé génétiquement. On constate jusqu’à 85 % de concordance entre l’âge de la ménopause d’une femme et celui de sa mère. » De même, « on sait que les femmes auront un risque cinq fois plus élevé en moyenne d’avoir une ménopause précoce ou une insuffisance ovarienne prématurée (IOP) s’il y a déjà un cas dans leur famille ».
Dans une étude publiée en 2022, Micheline Misrahi-Abadou et son équipe se sont justement intéressés à des patientes présentant une IOP. Chez 30 % d’entre elles, ils ont mis en évidence des causes génétiques. Au total, les scientifiques ont identifié une centaine de gènes qui, lorsqu’ils portent des anomalies importantes, conduisent à une IOP ou une ménopause précoce. « De façon intéressante, on s’aperçoit que ce sont ces mêmes gènes qui contrôlent l’âge de la ménopause physiologique. En fonction des femmes, ils vont fonctionner plus ou moins bien, et donc entraîner une ménopause plus ou moins tardive. » Plus intéressant encore, les gènes les plus souvent impliqués appartiennent à une famille connue pour jouer un rôle majeur dans la réparation de l’ADN.
Pour la spécialiste, ce n’est pas une surprise : « Il faut s’imaginer que l’ovocyte formé avant la naissance vit en moyenne cinquante ans, sans se diviser, ni se réparer. Et pendant tout ce temps, il est soumis à de nombreuses agressions, par des toxines internes ou externes, qui altèrent en particulier son précieux ADN. » Réparer cet ADN favoriserait donc la survie des ovocytes. De la même façon, l’équipe a identifié d’autres familles de gènes dont l’une est impliquée dans la croissance des follicules et l’autre, dans les fonctions métaboliques et mitochondriales. « Les mitochondries, c’est ce qui fournit de l’énergie et permet la croissance folliculaire et la maturation de l’ovule. Sans énergie et avec des altérations métaboliques, ça ne peut plus fonctionner », souligne la chercheuse dont le laboratoire UGM3R a été labellisé « laboratoire national de référence pour les infertilités génétiques ».
Ces découvertes ont fait évoluer les recommandations européennes en matière de prise en charge des patientes souffrant d’insuffisance ovarienne prématurée. Mais les perspectives vont au-delà, selon Micheline Misrahi-Abadou. À terme, ces recherches pourraient aboutir à un test génétique capable d’évaluer la quantité et la qualité de la réserve ovarienne et donc de prédire, pour chaque femme, l’âge de sa ménopause. Avec un tel test, « les femmes auraient la possibilité d’organiser leur vie reproductive et professionnelle, parce que ce n’est pas la même chose d’avoir une ménopause à 47 ans ou 55 ans, sachant que la fertilité chute de façon importante au cours des dix ans qui la précèdent. »
Des variations hormonales qui chamboulent l’organisme
Au niveau biologique, le phénomène ne se résume pas à une disparition de la réserve ovarienne. Il se caractérise aussi par d’importantes variations hormonales. Durant la périménopause, « il y a une chute de l’hormone féminine principale qui est l’œstrogène, ainsi que de la progestérone », appuie Marianne Canonico, chercheuse au sein de l’équipe Exposome, hérédité, cancer et santé du Centre de recherche en épidémiologie et santé des populations (CESP – Univ. Paris-Saclay/Inserm/UVSQ). « Mais cette chute n’est pas continue, c’est une période de déséquilibre. On observe en réalité des pics, avec des périodes d’hyper-oestrogénie [une production excessive d’oestrogène] et d’hypo-oestrogénie [une production insuffisante]. »
Ce sont ces changements hormonaux qui sont à l’origine des dérèglements du cycle menstruel observés en périménopause. Ils sont aussi responsables de ce qu’on appelle les symptômes climatériques : les bouffées de chaleur, les sueurs nocturnes, les troubles du sommeil ou encore les troubles génito-urinaires. Si l’origine de ces symptômes n’est pas totalement expliquée, on sait que les œstrogènes influent sur de nombreux systèmes de l’organisme, dont le cerveau, le système cardiovasculaire, les muscles, les os, les muqueuses, etc. La diminution de ces hormones irait ainsi de pair avec celle de leurs effets sur l’organisme.
Les manifestations de la ménopause, de même que leur intensité, sont néanmoins très variables. Selon l’Institut national de la santé et de la recherche médicale (Inserm), 20 à 25 % des femmes concernées présentent des signes modérés à sévères qui affectent leur qualité de vie. Les bouffées de chaleur et les insomnies figurent en tête des troubles les plus handicapants. Mais la santé mentale peut aussi être mise à rude épreuve. « La préménopause constitue une fenêtre de vulnérabilité pour la dépression », souligne Hugo Bottemanne, psychiatre et chercheur au sein de l’équipe MOODS (Dépression, suicide, médicament) du CESP. « On estime que, durant cette période, 30 % des femmes ont des symptômes dépressifs tels qu’un manque d’énergie, de plaisir, de l’irritabilité. »
Parfois, les troubles psychologiques précèdent les troubles climatériques. Ils peuvent aussi les augmenter. « Les femmes déprimées ont plus de réveils nocturnes, de bouffées de chaleur. À l’inverse, les troubles du sommeil liés aux symptômes climatériques augmentent le risque de dépression. » Là encore, les mécanismes impliqués restent à élucider. « On observe une double corrélation intrigante entre les symptômes climatériques et dépressifs : les traitements antidépresseurs diminuent les premiers et les traitements contre les troubles climatériques améliorent les seconds », relève le chercheur. Ces troubles auraient-ils des voies pathologiques communes dans l’organisme ? On l’ignore mais les variations hormonales serviraient bien de socle commun.
Chez les femmes, la dépression est deux fois plus fréquente que chez les hommes. Et les œstrogènes n’y seraient pas pour rien. « Ces hormones ont des effets tant sur l’activité que sur la morphologie cérébrale, en modifiant par exemple la conformation des réseaux neuronaux et la façon dont ils interagissent entre eux. Elles influent aussi sur certains neurotransmetteurs », détaille le psychiatre co-auteur du livre La dépression au féminin. Les périodes de changements hormonaux importants constitueraient alors autant de fenêtres de vulnérabilité pour les femmes. « La dépression préménopausique, comme la dépression du post-partum après la grossesse, est liée à une période de changements de vie associée à des facteurs de stress qui se combinent aux changements hormonaux, avec un effet boule de neige. »
Afin d’éclairer les ressorts de la dépression féminine, Hugo Bottemanne explore l’hypothèse de l’intéroception. Pour interpréter le monde autour de lui, le cerveau se base sur les perceptions du monde externe. C’est l’extéroception. Mais il se base aussi sur tous les signaux physiologiques provenant du corps. C’est l’intéroception. « La réactivité émotionnelle varie en fonction du traitement de ces signaux. On s’aperçoit que dans les troubles psychiatriques, on a une dysrégulation de ces processus. Le cerveau perçoit mal les signaux, les traite mal et les régule mal. » L’hypothèse formulée serait qu’au cours de leur vie, et en particulier à certaines périodes comme la grossesse et la ménopause, les femmes connaîtraient des modifications intéroceptives importantes susceptibles de perturber le traitement des signaux et d’augmenter le risque de dépression.
Une perception culturelle négative de la ménopause
Pour le chercheur, cette hypothèse ne suffit toutefois pas à justifier la sur-prévalence de la dépression chez les femmes. Celle-ci serait aussi favorisée par des facteurs sociaux, notamment à la ménopause. « La perception culturelle de la ménopause fait partie des facteurs de stress. En Occident, nous avons de nombreux stéréotypes à ce sujet qu’on ne retrouve pas dans d’autres cultures », relève le psychiatre. Le mot « ménopause » n’a par exemple pas d’équivalent dans la langue japonaise. Le vieillissement y est désigné par un terme s’appliquant aux femmes comme aux hommes et incluant toutes les transformations liées, de l’arrêt des règles au blanchiment des cheveux.
« Dans notre société, la ménopause est encore perçue comme dégradante et injuste pour les femmes par rapport aux hommes dont la fertilité se poursuit très longtemps. Au contraire, ce n’est pas du tout une injustice : la femme a deux vies, l’une reproductive et l’autre économique et sociale », affirme Micheline Misrahi-Abadou. Selon la spécialiste, ce ne serait pas un hasard que la ménopause, quasi unique dans le règne animal, soit apparue dans l’espèce humaine. « La ménopause doit nécessairement avoir un intérêt parce que, d’un point de vue évolutif, ça n’a pas de sens de faire survivre un individu incapable de se reproduire. »
Diverses hypothèses sont avancées pour élucider cette étrangeté évolutive. L’une d’elles invoque les risques vitaux associés à la grossesse et à l’accouchement. Avec l’élargissement de la boîte crânienne et la modification du bassin survenus au sein du genre Homo, les complications obstétricales seraient devenues plus fréquentes, entraînant des risques pour la mère et l’enfant. Ajouté aux risques d’anomalies chromosomiques, qui augmentent avec l’âge maternel, cet argument aurait favorisé une limitation du temps de la reproduction pour ne pas mettre en jeu la survie des femmes et des enfants.
Parmi les théories avancées, une autre suggère qu’en déchargeant les femmes de leur fonction reproductive, la ménopause leur confère un rôle plus important dans la vie sociale et économique. « Dans les sociétés de chasseurs-cueilleurs, on observe que les femmes ménopausées ont une productivité économique plus importante. Ce sont celles qui ont acquis le plus de compétences et de connaissances et qui les transmettent aux générations suivantes. » Ce même schéma se retrouverait d’ailleurs chez les quelques rares autres espèces connaissant une ménopause, comme les orques dont les groupes sont généralement conduits par une femelle plus âgée.
Un traitement remis en question dans les années 2000
Si la ménopause est bien vécue par de nombreuses femmes, les troubles qui y sont associés sont susceptibles de changer cette étape en véritable épreuve pour certaines. Pour en réduire les manifestations, il existe un traitement hormonal de la ménopause (THM) qui vise à compenser la baisse hormonale via l’apport d’œstrogènes, complété ou non par des progestatifs. « Avant les années 2000, plus de 50% des femmes ménopausées étaient traitées. Mais aujourd’hui, moins de 10 % d’entre elles le sont », précise Marianne Canonico. Cette baisse drastique fait suite à « un énorme chamboulement survenu après la publication de deux essais américains en 2002 et 2004 ».
Menés sur quelque 26 000 sujets ménopausés, ces essais ont mis en évidence des risques accrus de cancer du sein et de plusieurs pathologies cardiovasculaires chez les femmes sous THM. « Cela a complètement remis en cause la balance bénéfice-risque des traitements », poursuit la chercheuse. Les traitements administrés aux États-Unis présentent cependant des différences notoires avec ceux utilisés en France. « Les Américains utilisent ce qu’on appelle des œstrogènes conjugués équins. Ce sont des molécules issues de juments gravides qui ne ressemblent pas du tout à la molécule utilisée en France, le 17-bêta-oestradiol, qui est identique à la molécule biologique circulante », détaille Marianne Canonico.
De même, ils ont recours à un progestatif de synthèse, très différent de la molécule bioidentique, la progestérone micronisée, employée en France. Une autre différence réside dans le mode d’administration de ce traitement, majoritairement donné par voie transdermique (patch ou gel) en France et par voie orale aux États-Unis. « La voie transdermique constitue une différence fondamentale. Lorsqu’on avale un médicament, il passe par le foie où cela fait s’emballer la cascade de coagulation. Par voie transdermique, la molécule n’y passe que plus tard, après avoir été en partie dégradée. Il n’y a donc pas cet effet-là. » En 2007, Marianne Canonico participe à une étude sur les « traitements à la française » et leur impact sur le risque de thrombose et d’embolie pulmonaire. Les travaux ne retrouvent pas les conclusions des essais américains, y compris en s’intéressant à des femmes présentant déjà des facteurs de risque thromboemboliques veineux.
« Ces résultats, bien que confirmés depuis par d'autres études, sont à prendre avec prudence parce qu’ils sont issus d’étude d’observation », concède la chercheuse. Mais ils tendent à rassurer les patientes sur la balance bénéfice-risque du THM, alors que les recommandations ont été très recentrées. Désormais, le traitement n’est indiqué qu’en cas de troubles altérant la qualité de vie, en prenant en compte les risques individuels des patientes. Les indications consistent à leur « donner la dose minimale pour la durée la plus courte » afin de les exposer le moins possible aux potentiels effets adverses.
Comprendre les effets à long terme de la ménopause
Mais que se passe-t-il après la ménopause ? Quels effets la chute des œstrogènes a-t-elle à long terme sur l’organisme ? Ce sont les questions explorées par Marianne Canonico et son équipe du CESP. « Aujourd’hui, une femme est exposée pendant un tiers de sa vie à cette période ménopausique. Ce n’est donc pas anodin de comprendre quels sont ses effets sur la santé des femmes, sur le vieillissement, la santé cardiovasculaire, les maladies neurodégénératives, les cancers, etc. » Pour leurs études, la chercheuse et ses collègues s’intéressent à l’ensemble de l’exposition hormonale des femmes. Autrement dit, de l’âge des premières règles à la ménopause naturelle ou artificielle (en cas de chirurgie ou de cancer par exemple), en passant par le nombre de grossesses et d’enfants, la prise d’un contraceptif et d’éventuels traitements pour la fertilité ou la ménopause. L’objectif est ensuite d’explorer l’effet de ces caractéristiques sur les paramètres considérés. Une étude publiée en 2023 se focalise ainsi sur la vitesse de marche de 34 000 femmes de 45 ans et plus, issues de la cohorte française Constances. En plus d’être facile à mesure, la vitesse de marche est « un paramètre intégratif qui est très prédictif de la santé d’une personne au cours du vieillissement, de bonnes aptitudes de marche étant associées à un risque moindre de chutes, d’hospitalisations et de décès », justifie Marianne Canonico.
Leurs travaux indiquent une vitesse plus faible chez les femmes ménopausées avant 45 ans par rapport à celle des femmes ménopausées entre 45 et 55 ans. En outre, ce paramètre semble être significativement plus bas chez les sujets ayant eu une vie reproductive (entre les premières règles et la ménopause) plus courte. « Ces résultats sont cohérents avec notre hypothèse de départ, celle d’un effet bénéfique des œstrogènes sur la vitesse de marche », résume la chercheuse, évoquant le rôle cardioprotecteur et neuroprotecteur des hormones ainsi que leur influence positive sur l’inhibition de la résorption osseuse et la masse musculaire. Dans une étude plus récente, l’équipe a utilisé les données de la cohorte E3N, incluant près de 100 000 Françaises suivies depuis 1990, pour s’intéresser cette fois-ci à la maladie de Parkinson. « Notre hypothèse de départ était que les femmes exposées aux œstrogènes le plus longtemps ou aux taux les plus élevés allaient moins développer la pathologie. Nous avons obtenu des résultats pas toujours évidents à interpréter mais qui semblent cohérents avec un effet neuroprotecteur de ces hormones. »
Les résultats indiquent que des règles précoces ou tardives, le fait d’avoir eu plusieurs enfants ou encore une ménopause artificielle, surtout si elle survient à un âge précoce, sont des facteurs associés à la maladie de Parkinson. « Il faut souligner qu’on ne peut pas tirer de conclusion causale à partir de nos recherches », insiste Marianne Canonico. « C’est le principe de l’épidémiologie observationnelle. L’idée est de considérer différents paramètres et de savoir si, plusieurs années après, ils sont associés ou non à un risque d’être malade. On peut alors avoir une stratégie de prévention plus ciblée. » Mieux connaître les effets de la ménopause pour améliorer la prise en charge et prévenir les pathologies associées, c’est tout l’enjeu de ces recherches dont le sujet reste trop peu exploré selon Micheline Misrahi-Abadou.
« Le fait de méconnaître la ménopause entraîne un coût considérable sur la santé des femmes. En ne traitant pas les symptômes qui doivent l’être, on crée des pathologies qui coûtent bien plus cher à la société, comme les maladies cardiovasculaires qui sont la première cause de mortalité féminine », rappelle la spécialiste. « Cela montre la nécessité de mieux informer le grand public mais aussi le corps médical pour traiter les femmes qui en ont besoin. »
Références :
- Heddar et al. Genetic landscape of a large cohort of Primary Ovarian Insufficiency: New genes and pathways and implications for personalized medicine, EBioMedicine, 2022.
- H. Bottemanne et L. Joly, La dépression au féminin, Éditions du rocher, 2024.
- Canonico et al., Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study, Circulation, 2007.
- Le Noan-Lainé et al., Characteristics of reproductive history, use of exogenous hormones and walking speed among women: Data from the CONSTANCES French Cohort Study, Maturitas, 2023.

Cet article est issu de L'Édition n°26.
L'intégralité du journal est à découvrir ici en version numérique.
Pour découvrir d'autres articles et sujets, abonnez-vous au journal L'Édition et recevez les prochains numéros :