Les rouages méconnus qui contrôlent nos gènes
(Cet article est issu de L'Édition n°20.)
Quel est le point commun entre la recherche de nouvelles thérapies contre le cancer, le mûrissement des tomates et la prédiction de la fertilité du sperme chez le taureau ? L’épigénétique, soit l’étude des mécanismes qui régulent l’expression des gènes sans modifier la séquence d’ADN. Car ce n’est pas toujours la séquence qui compte, mais la manière de s’en servir qui importe.
Blotti au coeur du noyau des cellules, l’ADN (ou acide désoxyribonucléique) contient toute l’information génétique (ou génome) d’un individu. Cette molécule s’organise en unités fonctionnelles, les gènes, qui à la manière d’un livre de cuisine rempli de recettes, déterminent les caractéristiques de l’individu ou de l’espèce. Telle une brigade de cuisine en perpétuelle activité, une multitude de molécules s’affaire dans le noyau et le cytoplasme des cellules. Certaines sont capables de reconnaitre les régions de l’ADN contenant les gènes et de lancer la fabrication des acides ribonucléiques messagers (ARNm) et leur exportation vers le cytoplasme, d’autres de traduire ces ARNm en protéines, elles-mêmes impliquées dans les fonctions cellulaires et la vie de l’individu. Mais parmi toutes les recettes disponibles dans le « livre » ADN, chaque type cellulaire choisit quels plats il concocte et en quelle quantité. Qu’est-ce qui détermine finalement ce « menu » ?
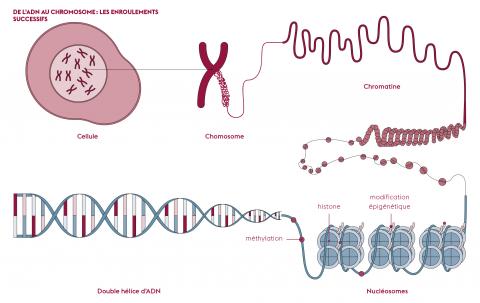
Le principal élément de réponse vient de la compaction de l’ADN. En effet, pour faire « entrer » la molécule dans le noyau d’une cellule, plusieurs niveaux de compaction sont nécessaires. L’ADN s’enroule d’abord autour de protéines, les histones, pour former des nucléosomes, unités de base de la chromatine. Hormis lors de la division cellulaire, où elle se présente sous la forme de chromosomes, la chromatine s’apparente davantage à une bobine de fil plus ou moins condensée. Les mécanismes moléculaires épigénétiques régissent le niveau de condensation ou de décondensation de la chromatine. Il s’agit de modifications chimiques, apposées directement sur les histones ou la molécule d’ADN. Ces modifications influencent l’expression des gènes, sans changer la séquence d’ADN. Certaines régions très condensées sont ainsi empaquetées en bobines si serrées qu’elles sont illisibles, comme si les pages du livre étaient collées entre elles. Pour en rendre la lecture possible, il faut décondenser la chromatine. En conséquence, la liste des pages accessibles est différente d’un type cellulaire à l’autre et change au cours du temps.
Dès lors, à la manière de critiques culinaires, les chercheurs et chercheuses en épigénétique de l’Université Paris-Saclay s’intéressent au choix et à l’exécution des plats concoctés par les cellules : ils et elles étudient plus particulièrement la régulation des modifications épigénétiques.
La méthylation comme pronostic du cancer
Une des modifications étudiées concerne la méthylation de l’ADN. Il s’agit de l’ajout d’un groupe méthyle (-CH3), c’est-à-dire un atome de carbone lié à trois atomes d’hydrogène, sur des cytosines – des bases nucléiques qui sont une des briques élémentaires de l’ADN. Les cytosines concernées se situent dans un environnement particulier de séquence d’ADN. Cette modification empêche en général l’expression des gènes situés à proximité.
Dans des travaux pionniers, les scientifiques du Laboratoire épigénétique et environnement (LEE) au Centre national de recherche en génomique humaine (CNRGH – Univ. Paris- Saclay, CEA) se sont intéressés à ce mode de régulation. L’équipe de Jörg Tost a notamment découvert qu’un différentiel de méthylation de l’ADN aide à établir un pronostic en cas de cancer du sein. À partir de biopsies des tumeurs, elle a suivi le profil épigénétique des cellules tumorales de patientes et patients au cours de la chimiothérapie. L’équipe a constaté que les personnes ayant bien répondu au traitement et survécu plusieurs années sont celles dont le profil de méthylation de l’ADN de ces cellules a été modifié lors de la chimiothérapie. Tout l’enjeu est désormais de réussir à utiliser la méthylation comme marqueur de prédiction précoce de la survie à long terme, et ce, dès la fin du traitement médicamenteux.
Établir un bilan épigénétique complet
Jörg Tost et son équipe s’intéressent également aux maladies inflammatoires. « Ces recherches ont énormément de potentiel, car les symptômes observés pour les maladies inflammatoires peuvent être presque tous liés à l’épigénétique, déclare le chercheur. Nous souhaitons, à partir d’une simple prise de sang, mettre en lumière quelles sont les marques épigénétiques révélatrices de l’état inflammatoire. » Pour l’instant, la technique n’en est qu’aux premiers stades de la recherche.
« Depuis quelques années, nous n’examinons plus seulement la méthylation de l’ADN, notre approche est plus complète. » Accessibilité de la chromatine, modification des histones, transcriptome codant et non codant, petits ARN : l’équipe scrute tous les niveaux de l’épigénétique pour comprendre quels changements moléculaires ont réellement un impact sur le fonctionnement du génome de l’individu. Le LEE combine désormais ses expertises en cancérologie et en maladie immunitaire, et mène des études en immuno-oncologie. L’objectif est de prédire les chances de succès d’une immunothérapie avant même de l’avoir commencée. « Cela sera un sujet d’étude majeur dans les prochaines années. L’épigénétique détient les clés de la médecine personnalisée du futur », promet Jörg Tost.
L’épigénétique : une trace écrite du vécu
Un autre axe d’étude concerne les effets de l’environnement sur les modifications épigénétiques. Le tabagisme, l’exposition à différents polluants ou la qualité de l’air peuvent par exemple modifier l’état épigénétique d’une cellule. « L’épigénome, l’ensemble des modifications épigénétiques, représente la mémoire de notre exposition. Grâce à lui, si votre mère habitait dans une exploitation agricole pendant sa grossesse et votre petite enfance, vous êtes beaucoup moins susceptible de développer des allergies ou de l’asthme », annonce Jörg Tost. Les bactéries bénéfiques résidant dans les étables de grands animaux sont à la base de cette protection : c’est l’épigénétique de l’immunité acquise.
« Tout ce qui se passe pendant la gestation peut avoir des conséquences à long terme », commentent Hélène Jammes et Anne Gabory, du laboratoire Biologie de la reproduction, environnement, épigénétique et développement (BREED – Univ. Paris-Saclay, UVSQ, INRAE, ENVA). L’équipe étudie le lien entre une modification de l’environnement maternel au cours de la gestation et les conséquences sur le développement de l’embryon puis du foetus et le devenir de l’individu en post-natal. Elle scrute notamment les mécanismes épigénétiques sous-jacents. « Il est important d’identifier les effets épigénétiques sur la descendance de tous les évènements survenant pendant la grossesse, précise Anne Gabory. Cela a un intérêt pour la prévention en médecine humaine mais aussi pour l’élevage. » Chez la souris, le contexte métabolique maternel influence ainsi le développement foeto-placentaire et prédispose à des réponses altérées. Lorsqu’une souris en surpoids donne naissance à des souriceaux, ceux-ci ont plus de risques de prendre du poids dans le cas d’un régime obésogène. Par ses travaux, l’équipe cherche à prédire, en analysant les marques épigénétiques présentes dans le sang des souriceaux d’une portée, lesquels seront en surpoids.
Pour autant, le profil épigénétique des parents se transmet-il à leurs enfants et petits-enfants, voire au-delà ? Si la transmission épigénétique sur plusieurs générations est prouvée chez les végétaux, le consensus scientifique n’est pas encore établi pour les animaux. Après la fécondation, la quasi-totalité des marques épigénétiques portées par les patrimoines génétiques paternel (provenant du spermatozoïde) et maternel (provenant de l’ovocyte) est remise à zéro. De nouvelles marques sont apposées lors du développement de l’embryon, ce qui semble, au premier abord, indiquer une absence de transmission épigénétique entre parents et enfants. Cependant, certains résultats expérimentaux démontrent que la vague d’effacement n’est pas complète. Hélène Jammes précise : « Nous préférons parler de transmission épigénétique intergénérationnelle, en parallèle à l’hérédité génétique. Il s’agit d’informations stockées au niveau du noyau cellulaire au cours de la gestation qui modifient la façon dont les cellules répondent à leur environnement. C’est ainsi que les souriceaux que nous étudions ont plus de risques de devenir obèses mais ne naissent pas en surpoids. »
Fertilité masculine : des taureaux et des hommes
Au sein de BREED, les scientifiques travaillent également sur la fertilité des ruminants. « Il peut paraître étonnant pour une même équipe de travailler sur différents modèles, mais nos questions biologiques et nos objectifs restent les mêmes : identifier les mécanismes épigénétiques qui contribuent à la mise en place des caractères et s’en servir comme outils de diagnostic et de pronostic », développe Hélène Jammes. Certains travaux récents rapportent une implication de l’information épigénétique transmise par le spermatozoïde du père au moment de la fécondation, sur le développement embryonnaire. Les taureaux, caractérisés génétiquement et sélectionnés selon des critères visant à améliorer la qualité de la viande ou du lait de la descendance, sont utilisés pour féconder de nombreuses vaches par insémination et obtenir une large descendance. Il devient possible d’évaluer la fertilité de ces individus avec précision.
Les scientifiques du laboratoire ont ainsi identifié quelques centaines de cytosines dont le taux de méthylation varie en lien avec la fertilité des taureaux. Les altérations de la méthylation ciblent des gènes impliqués dans la physiologie du sperme et le développement embryonnaire. « L’épigénétique n’est pas un tsunami, mais s’apparente plutôt à de la dentelle », nuance Hélène Jammes. En combinant données épigénétiques et intelligence artificielle, les scientifiques ont produit un modèle mathématique capable de prédire la fertilité du taureau à plus de 70 %. Ces travaux aident en outre à mieux comprendre l’infertilité masculine humaine. Le modèle bovin est également exploité dans le cadre du projet européen RUMIGEN, afin d’explorer les relations entre transmission d’informations épigénétiques par voie paternelle et performances de la descendance.
La diversité épigénétique au cœur de l’élevage
Le projet GEroNIMO (Genome and epigenome enabled breeding in monogastrics), co-coordonné par Tatiana Zerjal, de l’unité Génétique animale et biologie intégrative (GABI – Univ. Paris-Saclay, INRAE, AgroParisTech) et Frédérique Pitel, cherche également à comprendre à quel point l’animal garde en mémoire les changements environnementaux. « Nous cherchons à savoir si l’exposition à un stress ou à d’autres influences de l’environnement laissent des traces dans les méthylations de l’ADN. Nous étudions la possibilité d’une transmission sur plusieurs générations, en analysant comment les changements de l’environnement parental modifient la progéniture à plusieurs générations de distance. » Le modèle d’étude choisi est inédit : il s’agit des poules et leurs oeufs. Par ailleurs, identifier le lien entre des marques épigénétiques et des caractéristiques agricoles intéressantes est également au coeur du projet. Il propose notamment d’analyser l’ADN et les marques épigénétiques sur quinze générations de porcs. Il s’agit pour les éleveurs de sélectionner, de manière classique, leurs animaux sur critères agronomiques, et pour les scientifiques de suivre leur épigénome au fil des générations.
« Nous combinons deux techniques, le GBS (Genotype-by-sequencing) et le MeDIP (Methylated-DNA- immunoprecipitation), afin de scruter la génétique et l’épigénétique des animaux. Nous analysons des milliers d’animaux, ce qui permet de faire de l’épigénétique des populations, aussi bien de porcs, de poules pondeuses que de cailles. Notre projet est centré sur les conséquences appliquées », annonce Tatiana Zerjal. L’épigénétique est ici utilisée à des fins de comparaison entre élevage en plein air et élevage en bâtiment, entre climat tempéré ou tropical, ou entre différentes races de porcs et de poules. Même si diversités épigénétique et génétique semblent liées, tout un pan de la variabilité épigénétique n’est pas encore expliqué. Le but de GEroNIMO est de développer de nouvelles stratégies de sélection et de conservation de cette diversité épigénétique, afin d’adapter l’élevage aux changements globaux.
Libérer les transposons de la tomate
Chez les plantes, les scientifiques fabriquent des lignées à l’épigénome altéré pour comprendre également comment la mémoire épigénétique est transmise entre les générations. Elles et ils utilisent pour cela l’outil d’édition du génome CRISPR-Cas9 ou « ciseaux moléculaires ». Cet outil de biologie moléculaire permet de couper l’ADN à un endroit précis, au niveau de séquences spécifiques (CRISPR), grâce à une protéine particulière (Cas9).
« Nous nous intéressons à l’aspect fonctionnel de l’épigénétique et avons besoin de ces outils génétiques associés à la bio-informatique pour traiter nos grandes quantités de données. En visant par exemple les gènes MET1, DML2 ou DDM1 de la plante, qui contrôlent la méthylation de l’ADN, nous empêchons la régulation via ce mécanisme épigénétique », explique Nicolas Bouché, chercheur à l’Institut Jean-Pierre Bourgin (IJPB – Univ. Paris-Saclay, INRAE, AgroParisTech). Son équipe s’intéresse à l’organisme modèle Arabidopsis thaliana, l’arabette des dames, une plante peu connue du grand public mais très utilisée par les scientifiques en raison de son génome simple et facile à étudier. Le chercheur a toutefois élargi son champ de recherche à une plante cultivée : la tomate. « L’épigénétique y a une importance toute particulière. Si l’on empêche la déméthylation d’un plant de tomates, les fruits n’arriveront pas à maturité. »
Le chercheur explique : « L’épigénome des plantes cultivées est complexe. L’une des principales différences entre l’arabette et la tomate repose sur la quantité de transposons présents dans leur génome. Ce sont des portions d’ADN qui peuvent se déplacer dans le génome et le modifier en s’insérant dans des gènes. Leur mobilité doit donc être très contrôlée. Ils représentent 20 % du génome chez A. thaliana, mais 70 % chez la tomate. Cette grande quantité de transposons est d’ailleurs commune à toutes les espèces cultivées. » Pour l’heure, le rôle des transposons n’est pas totalement élucidé. En général réprimés par des méthylations de l’ADN, ils restent silencieux et inactifs. Dans les serres de l’IJPB, les plantes modifiées par CRISPR-Cas9 pour diminuer leur taux de méthylation ne contrôlent plus leurs transposons, ce qui provoque des perturbations radicales de la régulation des gènes. Les changements observés suite à ces perturbations servent à associer des régions épigénétiques à un caractère agronomique donné, tel que la croissance ou le temps de floraison. L’équipe s’intéresse notamment aux facteurs épigénétiques qui contrôlent la croissance de la plante en période de sécheresse. Un enjeu majeur dans un contexte de réchauffement climatique.
Épi-génétique du blé
En matière de changement climatique, il ne fait aucun doute que celui-ci aura un impact fort sur les cultures, en particulier de blé, très sensible à la chaleur. Dans le cadre du projet 3DWheat, lauréat d’une bourse ERC Consolidator 2022, l’équipe de Moussa Benhamed, de l’Institut des sciences des plantes de Paris-Saclay (IPS2 – Univ. Paris-Saclay, CNRS, INRAE, Univ. d’Évry, Univ. Paris Cité), explore la réponse épigénétique de cette céréale à de fortes températures. Lorsqu’il fait trop chaud, l’organisme est en stress, ce qui modifie sa physiologie. Ce changement pourrait être médié par des mécanismes épigénétiques.
L’équipe de Moussa Benhamed s’intéresse plus particulièrement aux modifications épigénétiques des histones. Par exemple, si une des histones porte une marque de répression, telle qu’une méthylation de la lysine 9 de l’histone H3, elle compacte l’ADN voisin en une bobine serrée. Au contraire, si l’histone porte une marque d’activation, comme l’acétylation de la lysine 14 de l’histone H3, elle laisse l’ADN autour d’elle lâche, ce qui permet l’expression des gènes. Des séquences d’ADN proches sont ainsi co-régulées et les gènes s’expriment en même temps. Parfois, une histone est doublement marquée. Les gènes situés à cet endroit sont dits bivalents et souvent impliqués dans la réponse au stress. L’équipe de Moussa Benhamed souhaite élucider les mécanismes moléculaires à l’oeuvre. « Quel est l’impact de cette bivalence ? La réponse des gènes face au stress est-elle plus rapide ? Cela confère-t- il une mémoire cellulaire ? »
Par ailleurs, comme la bobine d’ADN forme des boucles, cela rapproche spatialement des gènes normalement éloignés dans la séquence génomique. Au microscope, les scientifiques de l’IPS2 y ont observé des agglomérats d’une enzyme, l’ARN polymérase. Ces agglomérats constituent de véritables usines à exprimer les gènes. « Ces usines connectent entre elles plusieurs boucles d’ADN, produisant un phénomène de co-régulation entre des gènes parfois éloignés de plusieurs milliers de nucléotides. Un autre enjeu du projet 3DWheat est d’étudier le rôle de ces usines épigénétiques et leur dynamique lors de la réponse à la chaleur », conclut Moussa Benhamed.
L’épigénétique, domaine en pleine expansion, s’appuie sur l’avancée rapide des technologies pour expliquer des phénomènes encore méconnus il y a quelques années. La recherche y jouera un rôle clé afin de surmonter les défis à venir en matière de santé humaine et d’adaptation des êtres vivants aux changements.
Publications :
- Corem, S., et al. Redistribution of CHH methylation and small interfering RNAs across the genome of tomato ddm1 mutants. The Plant Cell, (2018).
- Costes, V. et al. Predicting male fertility from the sperm methylome: application to 120 bulls with hundreds of artificial insemination records. Clinical epigenetics, vol. 14, 54, (2022).
- Coustham, V., et al. Epigenetics at the interface between environment and DNA: what importance for breeding practices and selection methods? Animal – science proceedings, vol. 13, 5, (2022).
- Fogel, O., et al. Deregulation of microRNA expression in monocytes and CD4+ T lymphocytes from patients with axial spondyloarthritis. Arthritis Res. Ther. 21, 51, (2019).
- Pedersen, C.A., et al. DNA methylation changes in response to neoadjuvant chemotherapy are associated with breast cancer survival. Breast Cancer Res. 24, 43 (2022).
- Safi-Stibler, S., Gabory, A., Epigenetics and the Developmental Origins of Health and Disease: Parental environment signalling to the epigenome, critical time windows and sculpting the adult phenotype. Seminars in Cell & Developmental Biology, vol. 97, (2020).